Рады, что вам понравилась статья 😊

Алгоритм для подсчёта числа дыхательных движений (чдд) и правила заполнение медицинской документации, заполнение температурного листа.

Цель:определить основные характеристики дыхания.
Показания:заболевания органов дыхания, и сердечно – сосудистой системы.
Противопоказания:нет.
Оснащение:часы (секундомер), температурный лист или лист сестринского наблюдения, ручка бумага.
Алгоритм:
| Этапы | Обоснование |
| I. Подготовка к процедуре:1. Доброжелательно и уважительно представиться пациенту. Уточнить, как к нему обращаться. | Установление контакта с пациентом. |
| 2. Предупредить пациента, что будет проведено исследование пульса. | Исключается возможность управления дыханием. |
| 3. Получить согласие пациента на проведение процедуры. | Обеспечиваются права пациента на информацию. |
| 4. Вымыть и осушить руки. | Обеспечение инфекционной безопасности |
| 5. Попросить пациента или помочь ему удобно лечь (сесть) в постели, чтобы видеть верхнюю часть его грудной клетки и живота (эпигастральную область). | Для уточнения (определения) типа и ритма дыхания. |
| 6. Определить тип и ритм дыхания. | Обеспечивается точность (достоверность) подсчета ЧДД. |
| II. Выполнение процедуры:7. Взять пациента за руку так, как для исследования пульса, наблюдать за экскурсией грудной клетки или за движениями эпигастральной области живота пациента. Считать дыхательные движения за 1 минуту. Примечание: если не удается наблюдать экскурсию грудной клетки, то положить руки (пациента и свою) на грудную клетку (у женщин) или на эпигастральную область (у мужчин), имитируя исследование пульса (продолжая держать руку за запястье) | Определение ЧДД |
| 8. Зафиксировать результат на бумаге и перенести данные в лист сестринского наблюдения или температурный лист. | Обеспечение контроля за состоянием органов дыхания и сердечно-сосудистой системы. |
| III. Окончание процедуры:9. Вымыть и осушить руки. | Обеспечение инфекционной безопасности. |
Цель:правила заполнение медицинской документации.
Показания:регистрация результатов обследования пациента.
Противопоказания:нет.
Оснащение:температурный лист, ручки (или карандаши) с красной, синей пастой.
Алгоритм:
| Этапы | Обоснование |
| I. Подготовка к манипуляции. 1. Приготовить стандартный температурный лист. 2. Приготовить синий или черный карандаш (или пасту), красный карандаш (или пасту). II. Выполнение манипуляции. 3. Утреннюю температуру отметить точкой в графе «У», вечернюю – в графе «В». 4. Отметить верхнюю границу (систолического) и нижнюю границу (диастолического) артериального давления красным карандашом (или пастой). 5. В графе «У» отметить точкой результаты подсчета пульса утром, а в графе «В» результаты подсчета пульса вечером. 6. В графе «Дыхание» записать подсчет числа дыхательных движений в 1 мин.. 7. В графе «Вес» сделать отметку о данных массы тела пациента. 8. В графе «Выпито жидкости» отметить количество жидкости, поступившей в организм пациента. 9. В графе «Суточное количество мочи» отметить количество мочи, выделенное пациентом за сутки. 10. В графе «Стул» отметить знаком + данные о дефекации. 11. В графе «Ванна» отметить знаком + о проведении санитарной обработки пациенту. III. Окончание манипуляции. 4. Соединить точки утренней и вечерней температуры. 5. Соединить точки результатов подсчета пульса. 6. Красным карандашом обозначить в виде столбика АД. |
Правила заполнения медицинской документации. Эффективное прочтение результатов обследования пациента. Достоверность результата. Достоверность результата. Достоверность результата. Информация для лечащего врача. Обеспечение преемственности в сестринском уходе. Информация для лечащего врача. Обеспечение преемственности в сестринском уходе. Информация для лечащего врача. Обеспечение преемственности в сестринском уходе. Информация для лечащего врача. Обеспечение преемственности в сестринском уходе. Получение температурной кривой. Графическое отображение результатов пульса. Эффективность заполнения медицинской документации. |





Лабораторная работа №7 Свойства белков Цветные реакции на белки и аминокислоты. С опытами: Биуретовая реакция, Реакция на «слабосвязанную серу»,Ксантопротеиновая реакция белков, Реакция Адамкевича (на присутствие в белках триптофана), Нингидриновая реакция, Реакция Сакагучи.

Значение цветных реакций состоит в том, что они дают возможность обнаружить присутствие белка в биологических жидкостях, растворах и установить аминокислотный состав различных природных белков. Эти реакции применяются как для качественного, так и для количественного определения белка и содержащихся в нем аминокислот. Некоторые реакции присущи не только белкам, но и другим веществам, например, фенол, подобно тирозину, дает розово-красное окрашивание с реактивом Миллона, поэтому проведения одной какой-либо реакции для установления наличия белка не достаточно.
Существует два типа цветных реакций: 1) универсальные – биуретовая (на все белки) и нингидриновая (на все а-аминокислоты и белки); 2) специфические – только на определенные аминокислоты как в молекуле белка, так и в растворах отдельных аминокислот, например реакция Фоля (на аминокислоты, содержащие слабосвязанную серу), реакция Миллона (на тирозин), реакция Сакагучи (на аргинин) и др.
При проведении цветных реакций на белки и аминокислоты необходимо предварительно составить следующую таблицу:
Цветные реакции на белки (качественные реакции)
| № | Название реакции | Применяемые реактивы | Появление окрашивания |
Что открывает данная реакция |
| 1 | Биуретовая и т.д. | |||
| Выводы … |
Биуретовая реакция – качественная на все без исключения белки, а также продукты их неполного гидролиза, которые содержат не менее двух пептидных связей.
Принцип метода. Биуретовая реакция обусловлена присутствием в белках пептидных связей (- СО – NH -), которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные в красно-фиолетовый цвет медные солеобразные комплексы. Биуретовую реакцию дают также некоторые небелковые вещества, например биурет (NH2-CO-NH-CO-NH2), оксамид (NH2CO-CO-NH2), ряд аминокислот (гистидин, серин, треонин, аспарагин).
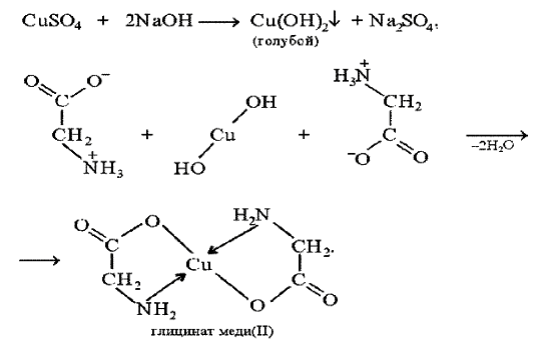
Биуретовая реакция с глицином
Порядок выполнения работы.
К 1 мл исследуемого 1% раствора белка добавляют равный объем 10 % раствора гидроксида натрия (NaOH) щелочи и затем 2-3 капли 1 % раствора сульфата меди (CuSO4). разбавленного, почти бесцветного раствора медного купороса.
При положительной реакции появляется фиолетовая окраска с красным либо синим оттенком.
Вывод:
Принцип метода. Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Порядок выполнения работы.
В пробирку наливают 1 мл неразбавленного куриного белка, прибавляют 2 мл 20%-го раствора гидроксида натрия. Смесь осторожно кипятят (чтобы смесь не выбросило).
При этом выделяется аммиак, который обнаруживается по посинению влажной лакмусовой бумажки, поднесенной к отверстию пробирки (не касаться стенки). Образующийся незначительный осадок растворяется при кипении, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Химизм реакции:
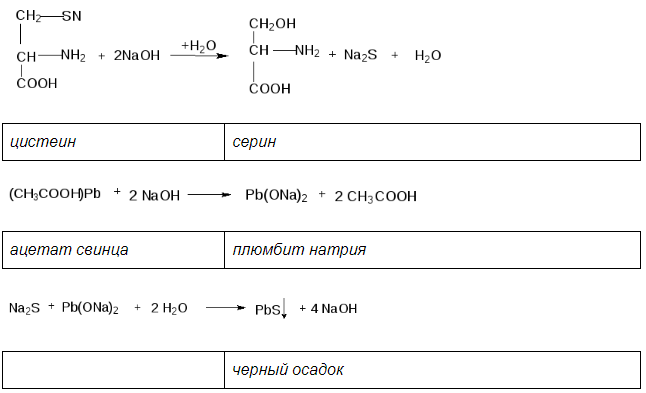
В пробирку наливают 1 мл. неразбавленного куриного белка добавляют 2 мл. концентрированного раствора щелочи, кладут несколько кипятильников. К горячему раствору добавляют раствор плюмбита натрия – образуется желто-бурое или черное окрашивание. (Плюмбит натрия готовят следующим образом: к 1 мл уксуснокислого свинца добавляют раствор щелочи по каплям до растворения образующего вначале осадка гидроксида свинца).
При наличии в молекуле белка серосодержащих аминокислот (цистина, цистеина) из этих аминокислот постепенно отщепляется сера в виде иона в степени окисления – 2, наличие которого и обнаруживается ионом свинца, образующим с ионом серы черный нерастворимый сульфид свинца:
Принцип метода. Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет. Желатин, например, не содержащий ароматических аминокислот, не дает ксантопротеиновой пробы.
Порядок выполнения работы.
К 1 мл 10 %-го раствора белка куриного яйца добавляют 0,5 мл концентрированной азотной кислоты. В результате коагуляции белка в содержимом пробирки образуется белый осадок или помутнение. При нагревании раствор и осадок окрашиваются в ярко-желтый цвет. При этом осадок почти полностью растворяется в результате гидролиза. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия (до появления оранжевой окраски раствора).
Рассмотрим механизм ксантопротеиновой реакции по радикалу тирозина:
Оформление опыта: сделать вывод и написать уравнение реакции.
Принцип метода. Белки, содержащие триптофан, в присутствии глиоксиловой и серной кислот дают красно-фиолетовое окрашивание. Реакция основана на способности триптофана взаимодействовать в кислой среде с альдегидами глиоксиловой кислоты (являющейся примесью к концентрированной уксусной кислоте) с образованием окрашенных продуктов конденсации. Реакция протекает по уравнению:.png)
Желатин не дает этой реакции, т.к. он не содержит триптофана. Окраска возникает за счет реакции триптофана с глиоксиловой кислотой, всегда присутствующей в уксусной кислоте в виде примеси.
Эту же реакцию на триптофан можно провести, используя вместо уксусной кислоты формальдегид 2,5%-ный раствор концентрированной H2SO4. Раствор перемешать и через 2-3 мин. добавить при взбалтывании 10 капель 5%-ного нитрита натрия. Развивается интенсивно-фиолетовое окрашивание, на этом основан принцип метода реакции.
Порядок выполнения работы.
В пробирку наливают несколько капель неразбавленного белка и прибавляют 2 мл. ледяной уксусной кислоты и несколько капель глиоксиловой кислоты. Смесь слегка нагревают до растворения образующегося осадка, охлаждают и, сильно наклонив пробирку, осторожно по стенке приливают концентрированную H2SO4 так, чтобы обе жидкости не смешивались.
Через 5-10 минут на границе раздела двух слоев наблюдают образование красно-фиолетового кольца.
Оформление опыта: сделать вывод и написать уравнение реакции.
Принцип метода. a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты. Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Продукт этой реакции содержит в своем составе радикал (R) исходной аминокислоты, который обусловливает различную окраску: голубую, красную, и т.д. соединений, возникающих при реакции аминокислот с нингидрином.
В настоящее время нингидриновая реакция широко используется как для открытия отдельных аминокислот, так и для определения их количества.
Порядок выполнения работы.
В пробирку наливают 1 мл 1-10%-го разбавленного раствора белка куриного яйца и 1-2 мл 1%-го раствора нингидрина в ацетоне. Содержимое пробирки перемешивают и в течение 2-3 мин осторожно нагревают на водяной бане до появления сине-фиолетового окрашивания, свидетельствующее о присутствии в белке α-аминокислот.
Оформление опыта: сделать вывод и написать уравнение реакции.
Принцип метода. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
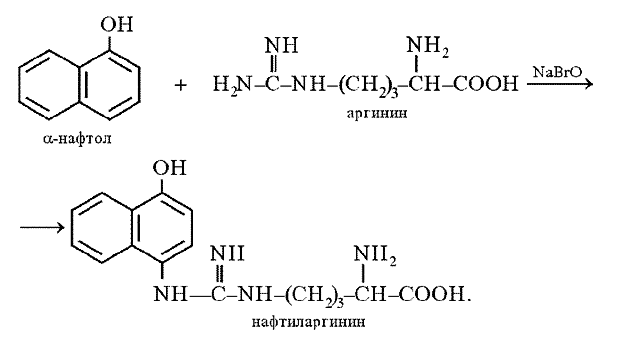
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a-нафтола:
Порядок выполнения работы.
К 2 мл. 1%-го разбавленного раствора белка куриного яйца добавляют 2 мл. 10%-го гидроксида натрия (NaOH) и несколько капель 0,2%-ного спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают. Затем приливают 0,5 мл. гипобромита натрия (NaBrO) или гипохлорита натрия (натрий хлорноватистокислый – NaOCl), перемешивают. Тотчас появляется красное, постепенно усиливающееся окрашивание.
Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации, быстро развивающегося оранжево-красного окрашивания.
Эта реакция характерна для соединений, содержащих остаток гуанидина
N H = C –NH2,
H = C –NH2,
NH2
и указывает на присутствие в белковой молекуле аминокислоты-аргинина:
NH = C –NH – (CH2)3 –CH –COOH
NH2 NH2
Оформление опыта: сделать вывод и написать уравнение реакции.


Работа по теме: Перечень манипуляций. Глава: 66. Расчет и техника разведения антибиотиков ( 1: 1; 1 : 2). ВУЗ: ВГСПУ.

Оснащение:
- флакон с сухим лекарственным средством;
- ампула с растворителем;
- одноразовый шприц;
- игла для набора лекарственного средства;
- спирт этиловый 70%;
- стерильные марлевые или ватные шарики;
- пинцет; - пилочка; - почкообразный лоток;
- маска;
- стерильные перчатки
Для разведения антибиотиков применяют следующие растворы:
Вода для инъекций в ампулах;
Раствор хлорида натрия 0,9% (изотонический, физиологический) в ампулах;
Раствор новокаина о,25%; 0,5% в ампулах.
Расчет дозы и техника разведения антибиотиков (1:1) – стандартный метод.
1 грамм сухого вещества соответствует1000.000 единиц действия (ЕД)
0,1грамм сухого вещества соответствует 100.000 единиц действия
на 100.000 ЕД пенициллина берут 1 мл растворителя;
на 200.000 ЕД пенициллина берут 2 мл растворителя;
на 300.000 ЕД пенициллина берут 3 мл растворителя;
на 400.000 ЕД пенициллина берут 4 мл растворителя;
на 500.000 ЕД пенициллина берут 5 мл растворителя;
на 600.000 ЕД пенициллина берут 6 мл растворителя;
на 700.000 ЕД пенициллина берут 7 мл растворителя;
на 800.000 ЕД пенициллина берут 8 мл растворителя;
на 900.000 ЕД пенициллина берут 9 мл растворителя;
на 1.000.000 ЕД пенициллина берут 10 мл растворителя;
Расчет дозы и техника разведения антибиотиков (1:2) – не стандартный метод.
на 100.000 ЕД пенициллина берут 0,5 мл растворителя;
на 200.000 ЕД пенициллина берут 1 мл растворителя;
на 300.000 ЕД пенициллина берут 1,5 мл растворителя;
на 400.000 ЕД пенициллина берут 2 мл растворителя;
на 500.000 ЕД пенициллина берут 2,5 мл растворителя;
на 600.000 ЕД пенициллина берут 3 мл растворителя
на 700.000 ЕД пенициллина берут 3,5 мл растворителя;
на 800.000 ЕД пенициллина берут 4 мл растворителя;
на 900.000 ЕД пенициллина берут 4,5 мл растворителя;
на 1.000.000 ЕД пенициллина берут 5 мл растворителя;
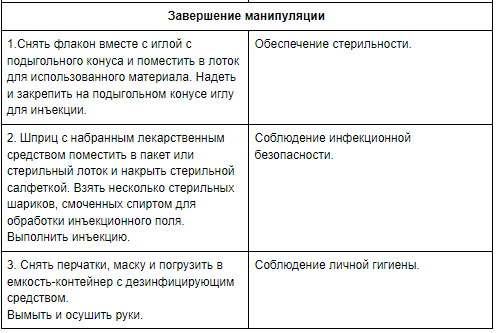
Расчет дозы и техника разведения антибиотиков.
Оснащение:
- флакон с сухим лекарственным средством;
- ампула с растворителем;
- одноразовый шприц;
- игла для набора лекарственного средства;
- спирт этиловый 70%;
- стерильные марлевые или ватные шарики;
- пинцет; - пилочка; - маска;
- стерильные перчатки; - почкообразный лоток;
Для разведения антибиотиков применяют следующие растворы:
1. Вода для инъекций в ампулах;
2. Раствор хлорида натрия 0,9% (изотонический, физиологический) в ампулах;
3. Раствор новокаина о,25%; 0,5% в ампулах.
Примечание: Если растворитель в упаковке не предусмотрен, то при разведении антибиотика на 0,1г (100 000ед) порошка берут 0,5мл растворителя.
Таким образом для разведения:
0,2г нужен 1мл растворителя;
0,5г нужно 2,5 – 3 мл растворителя;
1г нужно 5 мл растворителя.